Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
千葉 薫*; 松井 拓郎*; 茶竹 俊行*; 大原 高志; 田中 伊知朗*; 油谷 克英*; 新村 信雄*
Protein Science, 32(10), p.e4765_1 - e4765_13, 2023/10
被引用回数:0 パーセンタイル:0(Biochemistry & Molecular Biology)In structural biology, peptide bonds, fundamental linkages between hundreds of amino acids, of which a protein molecule is composed, have been commonly treated as a plane structure just as Linus Pauling et al. proposed. In this paper, a site-specific peptide bond relaxation mechanism by deuterons whose localization has been suggested by neutron crystallography is proposed. A comprehensive study using X-ray and neutron diffraction and 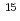 N chemical shifts of individual amide nitrogen atoms within the same peptide bond strongly suggests the relaxation of the electronic resonance structure because of site-specific modulation by protons/deuterons localized on the electron orbital of the carbonyl oxygen.
N chemical shifts of individual amide nitrogen atoms within the same peptide bond strongly suggests the relaxation of the electronic resonance structure because of site-specific modulation by protons/deuterons localized on the electron orbital of the carbonyl oxygen.
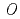 -glucosyltransferase from
-glucosyltransferase from 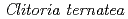
廣本 武史; 本庄 栄二郎*; 野田 尚信*; 玉田 太郎; 数馬 恒平*; 鈴木 正彦*; Blaber, M.; 黒木 良太
Protein Science, 24(3), p.395 - 407, 2015/03
被引用回数:62 パーセンタイル:88.58(Biochemistry & Molecular Biology)チョウマメの花弁に含まれるUDP-glucose: anthocyanidin 3-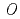 -glucosyltransferase(UGT78K6)は、UDP-glucoseを糖供与体とし、青色色素の基本骨格をなすデルフィニジンへの糖転移を触媒する酵素である。本酵素は、「フラボノール」に類似した化学構造を有するにもかかわらず、デルフィニジンなど「アントシアニジン」特異的な糖転移活性を示す。その糖受容体認識に関わる構造基盤を明らかにするため、UGT78K6単独の立体構造ならびに各糖受容体(アントシアニジンに分類されるデルフィニジンとペチュニジン、またフラボノールの一種であるケンフェロール)が結合した複合体の立体構造をX線結晶構造解析により決定した。今回の研究で見出された糖受容体の結合様式は、これまでに報告されている類似の糖転移酵素(赤ブドウ由来
-glucosyltransferase(UGT78K6)は、UDP-glucoseを糖供与体とし、青色色素の基本骨格をなすデルフィニジンへの糖転移を触媒する酵素である。本酵素は、「フラボノール」に類似した化学構造を有するにもかかわらず、デルフィニジンなど「アントシアニジン」特異的な糖転移活性を示す。その糖受容体認識に関わる構造基盤を明らかにするため、UGT78K6単独の立体構造ならびに各糖受容体(アントシアニジンに分類されるデルフィニジンとペチュニジン、またフラボノールの一種であるケンフェロール)が結合した複合体の立体構造をX線結晶構造解析により決定した。今回の研究で見出された糖受容体の結合様式は、これまでに報告されている類似の糖転移酵素(赤ブドウ由来 GT1)とケンフェロールとの結合様式とは全く異なるものであり、発色の異なる糖受容体「アントシアニジン」と「フラボノール」をどのように識別しているのか、その分子メカニズムの解明を可能とした。今後、得られた構造情報を基に糖受容体との相互作用部位を改変することにより、色味の異なる色素化合物の合成あるいは医薬品候補分子の合成を可能にするものと期待される。
GT1)とケンフェロールとの結合様式とは全く異なるものであり、発色の異なる糖受容体「アントシアニジン」と「フラボノール」をどのように識別しているのか、その分子メカニズムの解明を可能とした。今後、得られた構造情報を基に糖受容体との相互作用部位を改変することにより、色味の異なる色素化合物の合成あるいは医薬品候補分子の合成を可能にするものと期待される。
安達 基泰; 平山 裕士; 清水 瑠美; 佐藤 勝也; 鳴海 一成*; 黒木 良太
Protein Science, 23(10), p.1349 - 1358, 2014/10
被引用回数:9 パーセンタイル:25.51(Biochemistry & Molecular Biology)DNAの修復に関与する多機能なPprAは、デイノコッカスラジオデュランスの高度な放射線耐性を促進する重要なタンパク質である。PprAによる放射線耐性機構を解明するために、大腸菌で発現した組換え型PprAと2本鎖DNAとの相互作用解析を実施した。ゲルシフトアッセイにより、PprAとスーパーコイル型のpUC19 DNAとの複合体のゲルシフトが2極性であり、それが1mMのMg, Ca, Srイオンで促進されることが示された。シフトしたバンドの相対的な割合からPprAとスーパーコイル型のpUC19 DNAとの複合体形成のヒル係数および解離定数を計算したところ、1mM Mgイオンの存在下で、それぞれ3.3と0.6 Mであった。このことは、PprAがスーパーコイル型のpUC19 DNAに少なくとも281分子結合していることを示しており、ゲル濾過での分離後にUV吸収で見積もられた値と一致した。この結果は、PprAが2本鎖DNAに沿って、直鎖状に重合して結合していることを示唆している。一方で、直鎖状の2本鎖DNAとニックがある環状DNAのバンドシフトに関しては、飽和が見られず、1.3
Mであった。このことは、PprAがスーパーコイル型のpUC19 DNAに少なくとも281分子結合していることを示しており、ゲル濾過での分離後にUV吸収で見積もられた値と一致した。この結果は、PprAが2本鎖DNAに沿って、直鎖状に重合して結合していることを示唆している。一方で、直鎖状の2本鎖DNAとニックがある環状DNAのバンドシフトに関しては、飽和が見られず、1.3 M以上のPprA濃度の時、さらに大きな複合体の形成が確認された。この結果は、DNAに結合したPprAが、ダメージを受けたDNAの末端の会合を濃度依存的に促進していることを示している。
M以上のPprA濃度の時、さらに大きな複合体の形成が確認された。この結果は、DNAに結合したPprAが、ダメージを受けたDNAの末端の会合を濃度依存的に促進していることを示している。
 KM1
KM1岡崎 伸生; 玉田 太郎; Feese, M. D.*; 加藤 優*; 三浦 裕*; 米田 俊浩*; 小林 和男*; 近藤 恵二*; Blaber, M.*; 黒木 良太
Protein Science, 21(4), p.539 - 552, 2012/04
被引用回数:3 パーセンタイル:6.67(Biochemistry & Molecular Biology)Glycosyltrehalose trehalohydrolase (GTHase) is an  -amylase that cleaves the
-amylase that cleaves the  -1,4 bond adjacent to the
-1,4 bond adjacent to the  -1,1 bond of maltooligosyltrehalose to release trehalose. In order to investigate the catalytic and substrate recognition mechanisms of GTHase, two residues, Asp252 (nucleophile) and Glu283 (general acid/base), located at the catalytic site of GTHase were mutated (Asp252
-1,1 bond of maltooligosyltrehalose to release trehalose. In order to investigate the catalytic and substrate recognition mechanisms of GTHase, two residues, Asp252 (nucleophile) and Glu283 (general acid/base), located at the catalytic site of GTHase were mutated (Asp252  Ser (D252S), Glu (D252E) and Glu283
Ser (D252S), Glu (D252E) and Glu283  Gln (E283Q)), and the activity and structure of the enzyme were investigated. The E283Q, D252E and D252S mutants showed only 0.04%, 0.03%, and 0.6% of enzymatic activity against the wild-type, respectively. The crystal structure of the E283Q mutant GTHase in complex with the substrate, maltotriosyltrehalose (G3-Tre), was determined to 2.6
Gln (E283Q)), and the activity and structure of the enzyme were investigated. The E283Q, D252E and D252S mutants showed only 0.04%, 0.03%, and 0.6% of enzymatic activity against the wild-type, respectively. The crystal structure of the E283Q mutant GTHase in complex with the substrate, maltotriosyltrehalose (G3-Tre), was determined to 2.6  resolution. The structure with G3-Tre indicated that GTHase has at least five substrate binding subsites and that Glu283 is the catalytic acid, and Asp252 is the nucleophile that attacks the C1 carbon in the glycosidic linkage of G3-Tre. The complex structure also revealed a scheme for substrate recognition by GTHase. Substrate recognition involves two unique interactions: stacking of Tyr325 with the terminal glucose ring of the trehalose moiety and perpendicularly placement of Trp215 to the pyranose rings at the subsites -1 and +1 glucose.
resolution. The structure with G3-Tre indicated that GTHase has at least five substrate binding subsites and that Glu283 is the catalytic acid, and Asp252 is the nucleophile that attacks the C1 carbon in the glycosidic linkage of G3-Tre. The complex structure also revealed a scheme for substrate recognition by GTHase. Substrate recognition involves two unique interactions: stacking of Tyr325 with the terminal glucose ring of the trehalose moiety and perpendicularly placement of Trp215 to the pyranose rings at the subsites -1 and +1 glucose.
 sp. nucleoside diphosphate kinase
sp. nucleoside diphosphate kinase新井 栄揮; 米澤 悌; 岡崎 伸生; 松本 富美子; 玉田 太郎; 徳永 廣子*; 石橋 松二郎*; Blaber, M.; 徳永 正雄*; 黒木 良太
Protein Science, 21(4), p.498 - 510, 2012/04
被引用回数:14 パーセンタイル:34.5(Biochemistry & Molecular Biology)さまざまな生物種で保存されているヌクレオシドニリン酸キナーゼ(NDK)は、4量体もしくは6量体構造を形成することが知られる。一方、中度好塩菌 sp. 593由来NDK(HaNDK)はNDKとしては例外的に2量体を形成し、E134A変異導入により4量体へ変換される。本研究では、ゲルろ過光散乱及びX線結晶解析により、中度好塩菌
sp. 593由来NDK(HaNDK)はNDKとしては例外的に2量体を形成し、E134A変異導入により4量体へ変換される。本研究では、ゲルろ過光散乱及びX線結晶解析により、中度好塩菌 sp. 593由来NDKにおけるE134A変異導入による多量体変換の機構を解明した。また、E134A変異型HaNDKの結晶中には、グラム陰性菌由来MxNDKに類似した4量体構造と大腸菌由来EcNDKに類似した4量体構造が交互に現れることを明らかにした。一般に蛋白質は会合することで熱安定性や基質親和性を増大することから、少ない変異導入による多量体構造の変化は、NDKがさまざまな環境に適合するために有効に寄与している可能性がある。
sp. 593由来NDKにおけるE134A変異導入による多量体変換の機構を解明した。また、E134A変異型HaNDKの結晶中には、グラム陰性菌由来MxNDKに類似した4量体構造と大腸菌由来EcNDKに類似した4量体構造が交互に現れることを明らかにした。一般に蛋白質は会合することで熱安定性や基質親和性を増大することから、少ない変異導入による多量体構造の変化は、NDKがさまざまな環境に適合するために有効に寄与している可能性がある。
山田 秀徳*; 玉田 太郎; 小坂 恵*; 宮田 幸平*; 藤木 伸哉*; 田納 優*; 守屋 雅之*; 山西 守*; 本庄 栄二郎; 多田 宏子*; et al.
Protein Science, 16(7), p.1389 - 1397, 2007/07
被引用回数:39 パーセンタイル:59.61(Biochemistry & Molecular Biology)タンパク質の結晶格子は分子表面同士の相互作用からなっている。結晶格子内へのタンパク質の導入のため、ロイシンジッパー様の疎水的な相互作用をヒト膵臓RNase1のへリックス2へ導入した。野生型ヒトRNase1の結晶化はまだ報告をされていないが、4残基のロイシンを導入したRNase1では複数の結晶化条件で結晶を得た。そのX線結晶構造をウシRNaseAの立体構造を用いて分子置換法により決定した。こうして決定されたヒトRNase1の立体構造は、ウシRNaseAの立体構造と大変似ており、導入したロイシン残基を介して2分子のRNase1が疎水的なパッキングしていた。ロイシン導入の効果をさらに検討するために、導入したロイシン残基の数を3残基,2残基と減らした変異体を調製し結晶化を行った。これらの場合もロイシン残基による疎水的なパッキングが形成されていた。一方、ロイシン残基をヒトRNase1の別のへリックス(へリックス3)に導入し、効果を検証した。その結果、4残基のロイシンを導入した変異体でも結晶化し、4分子のRNase1が導入したロイシン残基を介してパッキングをしていることがわかった。これらの結果は、適切なロイシン導入により分子内対称性が生じ、より効果的に結晶化を促進する可能性を示す。
松田 敬子*; 西岡 孝明*; 木下 賢吾*; 川端 猛*; 郷 信広
Protein Science, 12(10), p.2239 - 2251, 2003/10
被引用回数:10 パーセンタイル:17.1(Biochemistry & Molecular Biology)蛋白質のスーパーファミリーの分類はアミノ酸配列,グローバルフォード,部分構造または機能などさまざまな基準でなされている。私達はグローバルフォールドと機能の関係だけでスーパーファミリーを定義できるかどうか調べた。はじめに、ベーターシートのトポロジーにもとづいて蛋白質のドメインを分類した。そして、分子進化の過程においてベーターシートの両端にストランドが1本だけ付加あるいは削除されて新しいベーターシートが作り出された、という仮定をしてベーターシート間の類縁関係を定義することにした。このベーターシート間の類縁関係に基づいて、あるドメインが他のドメインに進化するのに必要な進化的イベントの数が2つのドメイン間の距離を表すように、蛋白質ドメインのネットワークを構築した。その後、core chemical functionが既知であるATP関連ドメインについてネットワーク上にマップした。解析の結果、ネットワーク上に分布したドメインは20個強の分離したクラスターを形成した。この結果は20個強のATP結合蛋白質のスーパーファミリーは各々独立に分子進化の過程で創成されたことを示している。このようにドメインのグルーバルフォールドと機能を保存しながら進化したことが、今日みられる蛋白質の構造と機能の関係が生まれた原因である。